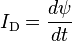Download Software Penghitung Molekul Dan Berat Atom | Free DownlOad SoftwarE | Penghitung Berat Atom - Molekul
Download Software Penghitung Molekul Dan Berat Atom | Free DownlOad SoftwarE | Penghitung Berat Atom - Molekul
Download Software Penghitung Molekul Dan Berat Atom | Free DownlOad SoftwarE | Software Penghitung Berat Atom Dan Molekul - Dalam pembahasan hal melakukan penghitungan terhadap berat molekul atau berat suatu atom, yang sering dilakukan oleh seseorang tersebut adalah dengan melihat pada tabel periodik kemudian menghitungnya dengan rumus - rumus yang telah ditentukan. Tentunya hal ini akan melalui proses yang lumayan panjang. Tetapi dengan menggunakan software penghitung berat molekul ini sobat tidak perlu melakukan hal yang merepotkan tersebut. dengan Molecular Weight Calculator tinggal memasukkan Unsur, atom atau rumus molekul kimia tertentu, kemudian klik tombol Calc Molecular Weight, maka berat atom, unsur/molekul akan langsung muncul, Download Software Penghitung Molekul-Berat Atom | Download Software Penghitung Berat Atom-Molekul.
Seperti contoh diatas masukkan rumus kimia KMnO4 kemudian tekan tombol Calc Molecular Weight, maka volume molekul tersebut akan muncul yaitu 158,03395 gram/mol. Cara lain adalah dengan membuka tombol Insert Element, maka tampilan seperti tabel periodik akan muncul. Pilih atom K, pilih atom Mn, Atom O dan ketikkan angka 4 kemudian klik OK. Setelah itu klik tombol Calc Molecular Weight. Satuan berat moleku ini adalah dalam g/mol,...
Download Software Penghitung Molekul Dan Berat Atom | Free DownlOad SoftwarE | Software Penghitung Berat Atom Dan Molekul bisa bermanfaat, jangan lupa tambahkan jaringan teman dan berikan donasi di KBG,.....
Sumber : http://kolombloggratis.blogspot.com/2012/07/download-software-penghitung-molekul.html#ixzz2NCzwYJ9D








 : Penurunan tekanan uap jenuh (atm)
: Penurunan tekanan uap jenuh (atm)

 : Besarnya penurunan titik didih (°C)
: Besarnya penurunan titik didih (°C)
 : Besarnya penurunan titik beku (°C)
: Besarnya penurunan titik beku (°C)










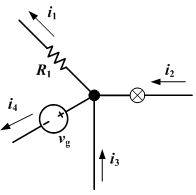

 dalam Ampere dapat diperoleh dengan persamaan:
dalam Ampere dapat diperoleh dengan persamaan:
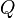 adalah
adalah  adalah waktu (time).
adalah waktu (time).





 adalah luas penampang total dan
adalah luas penampang total dan  adalah rapat arus dalam satuan A/m2.
adalah rapat arus dalam satuan A/m2.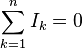
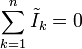
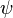 , yang disebut Maxwell sebagai arus perpindahan
, yang disebut Maxwell sebagai arus perpindahan  dan disatukan dengan rumus
dan disatukan dengan rumus